Fast die Hälfte aller Haushalte in Deutschland hat kalkhaltiges Wasser. Beratung und Verkauf geeigneter Kalkschutzmaßnahmen sind für das SHK-Handwerk herausfordernd: neue TrinkwV, mehr Verbraucherschutz, strengere Vorgaben hinsichtlich der Wasserbehandlung in der Haustechnik. Hinzu kommen enormer Kostendruck bei Neubau und Sanierung sowie gleichzeitig ein hoher Anspruch an nachhaltige und umweltfreundliche Technologien. Deshalb ist für Installateure und Planer jetzt der richtige Zeitpunkt, sich über wirksame, in der Praxis bewährte, trinkwasserkonforme und DVGW-zertifizierte Produkte umfassend zu informieren.
Kalksteinbildung – Ursache und Trendindikatoren
Das Kalkproblem kommt aufgrund der besonderen Eigenheiten der Löslichkeit von Kalk im Wasser zustande. Bei vielen Stoffen gilt, dass die Löslichkeit des Stoffes mit der Temperatur des Wassers steigt. Bei Kalk jedoch sinkt die Löslichkeit mit der Temperatur, d. h. wärmeres Wasser scheidet bereitwilliger Kalk ab als kälteres Wasser derselben Zusammensetzung.
Neben der Temperatur ist Kohlensäure ein Hauptakteur bei der Lösung von Kalk in Wasser. Kalk (CaCO3) ist in kohlensäurefreiem Wasser mit ca. 14 mg/l (bei 20 °C) nur schwer löslich. In mit Kohlendioxid gesättigtem Wasser (im Gleichgewicht mit der Atmosphäre) können dagegen bei 20 °C ca. 47 mg Kalk pro 1 l Wasser gelöst werden.
Mithilfe des Kalk-Kohlensäure-Gleichgewichtes kann aus den Analysewerten (hier: Ca- und Mg-Gehalt, pH-Wert, Carbonat-Konzentration und Temperatur) des Wassers sein thermodynamischer Zustand bei einer vorgegebenen Temperatur bestimmt und damit berechnet werden, ob das Wasser bezüglich CaCO3 lösend, im Gleichgewicht oder abscheidend ist.
Das Kalk-Kohlensäure-Gleichgewicht
Ein einfaches, qualitatives Bild des Kalk-Kohlensäure-Gleichgewichtes kann anhand einer Waage vermittelt werden. Auf der rechten Seite der Waage sind die wichtigsten Größen, die die Löslichkeit von Kalk bestimmen, abgebildet. Kippt die Waage nach rechts, also in den Bereich der Übersättigung, ist die Menge an Kalk, die das Wasser in Lösung halten kann (symbolisiert durch den Wassertropfen), überschritten.
Ist die Waage im Gleichgewicht, befinden sich exakt so viele Calcium- und Carbonationen in Lösung, wie das Wasser (bei gegebenem pH‑Wert und Temperatur) aufnehmen kann. In diesem Zustand spricht man von Wasser im Gleichgewicht oder (calciumcarbonat-)gesättigtem Wasser. Wasser im Gleichgewicht löst keinen Kalk auf und scheidet auch keinen Kalk ab.
Sind jedoch im Wasser weniger Calcium- und Carbonationen gelöst, als es in Lösung halten kann, kippt die Waage nach links in den Bereich der Untersättigung. Hier spricht man von untersättigtem oder kalkaggressivem Wasser, da dieses Wasser im Kontakt mit Kalk diesen so lange auflöst, bis der Calcium- und Carbonationengehalt dem des Gleichgewichtes entspricht.
Übersättigtes oder kalkabscheidendes Wasser hingegen liegt vor, wenn mehr Calcium- und Carbonationen in Lösung sind, als das Wasser aufnehmen kann. Um wieder ins Gleichgewicht zu gelangen, muss das Wasser den Überschuss an Ionen in Form von Kalkausfall ausbalancieren.
Das Kalk-Kohlensäure-Gleichgewicht ist in der SHK-Praxis also ein Trendindikator und dient zugleich als geeignete Risikoanalyse, um das Kalkabscheidepotenzial von Wasser zumindest annäherungsweise bestimmen zu können. Üblicherweise machen sich auch Wasserversorger dieses Rechenmodell zunutze, da der Gesetzgeber vorschreibt, dass kein korrosiv wirkendes Wasser im Versorgungsnetz bereitgestellt werden darf. Die Calcitlösekapazität für Wasserversorgungsanlagen und das Verteilungsnetz sollte nach Anlage 3 der TrinkwV den Wert von 5 mg/l nicht überschreiten.
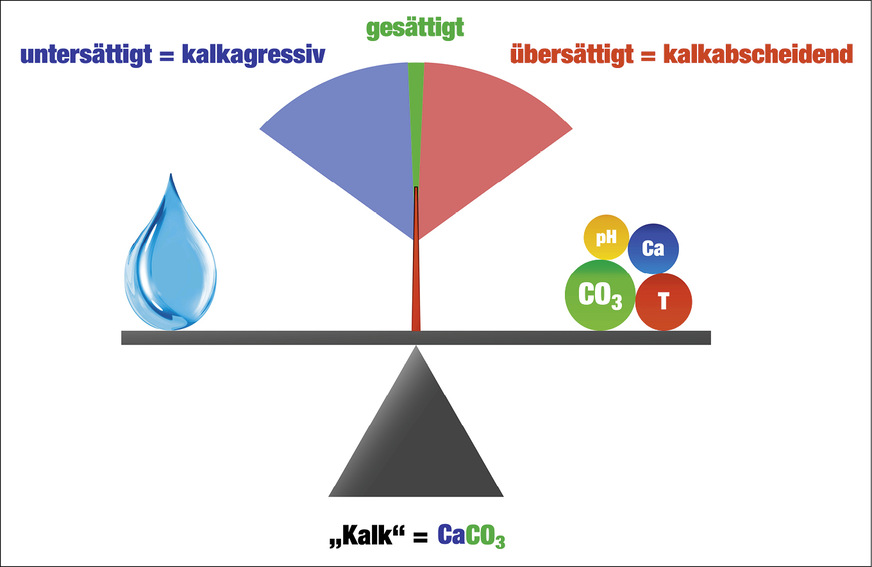
Bild: Watercryst
Exkurs: Thermodynamische Prozesse
Kalkabscheidendes Wasser muss den Überschuss an Ionen als Kalk abscheiden, um in sein Gleichgewicht zu kommen – und tut es auch. Es lässt sich allein aus der Konzentration der Härtebildner, insbesondere der Calciumkonzentration, nicht vorhersagen, wie schnell der Kalkausfall stattfindet.
Spontane, sogenannte homogene Kristallkeimbildung und danach weiteres Kristallwachstum, das zum Ausfall von Kalk aus der Wassersäule selbst führt, erfolgt nur bei sehr hoher, mindestens 10- bis 20-facher Übersättigung. Daher können viele Gewässer selbst im übersättigten Zustand vom Wasserversorger angeliefert werden, ohne dass das Versorgungsnetz massiv verkalkt und gebrauchsuntauglich wird.
Moderat übersättigtes Wasser hingegen, das am häufigsten in der Trinkwasser-Installation vorzufindende harte Wasser, kann diesen Zustand über einen gewissen Zeitraum aufrechterhalten. Bei ausreichend langer Wechselwirkung des Wassers mit Rohrinnen- und Behälterwänden sowie insbesondere Wärmeübertragungsflächen ist Kalkausfall die Folge.
Kristallwachstum und Aktivierungsenergiebarriere
Ursächlich verantwortlich für diese empirischen Wirkzusammenhänge hinsichtlich des Kalkabscheideverhaltens in übersättigtem Wasser ist die chemisch-physikalische Gesetzmäßigkeit, dass ein stabiles Kristallwachstum erst dann zustande kommt, wenn Kalkkristallkeime einer kritischen Größe (r*) ausgebildet werden. Hierfür muss die sogenannte Aktivierungsenergiebarriere (∆G*) überwunden werden. Solange diese kritische Größe nicht erreicht wird, lösen sich (statistisch gesehen) gebildete Kristallkerne wieder auf, neue werden wieder gebildet, lösen sich wieder auf usw. Erst wenn sie in ein stabiles Kristallwachstum übergehen, fällt der gelöste Kalk aus.
In der klassischen Kristallkeimbildungstheorie wird dies so beschrieben, dass beim Hinzufügen eines neuen Bausteins zu einem Komplex zwar Bindungsenergie (∆GV) gewonnen wird, die Vergrößerung der Oberfläche des Komplexes aber Energie (∆GA) verbraucht. Der Bindungsenergiegewinn wächst mit der dritten Potenz des Radius des Komplexes; der Energieverbrauch zur Vergrößerung der Oberfläche wächst quadratisch. Ab einer bestimmten Größe (kritische Keimgröße r*) übersteigt der Bindungsenergiegewinn den Energieverbrauch und das weitere Wachstum erfolgt spontan unter Energiegewinn.
Das Vorhandensein einer heterogenen Oberfläche kann jetzt die Aktivierungsenergiebarriere (∆G*) deutlich verringern. Dies ist der Grund, warum bei kleineren Übersättigungen – wie sie in der SHK-Praxis vorkommen – bevorzugt heterogene Prozesse zu Kalkausfall führen. Die Aktivierungsenergiebarriere (∆G*) ist umso kleiner, je ähnlicher die Oberfläche des heterogenen Substrates der Oberfläche des zu nukleierenden (keimbildenden) Kristalls ist.
Grenzt die Wassersäule also an eine Behälterwand mit geeigneter heterogener Oberfläche, so kann in dieser Grenzschicht (bei ausreichend langer Kontaktzeit) die notwendige Aktivierungsenergie zur Bildung von Kalkkristallkeimen der kritischen Größe drastisch reduziert werden. Das führt zu einer deutlichen Beschleunigung der Kristallisation an der Oberfläche unter Ausnutzung derer heterogenen Strukturen – und entsprechende Kalkablagerung an der Innenwand ist die Folge des Wachstums der dort gebildeten und haftenden Kalkkristallkeime.
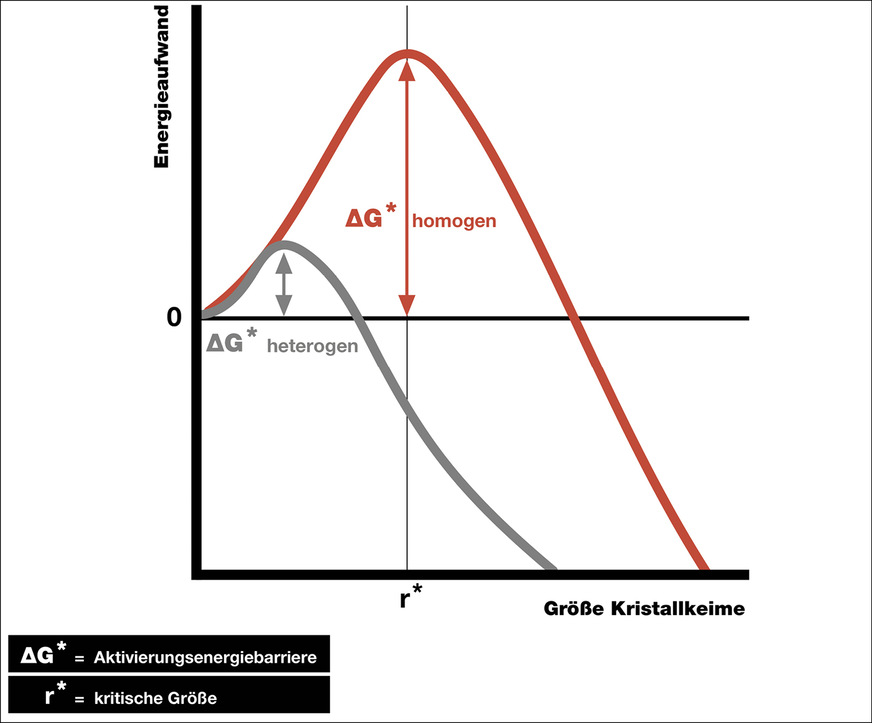
Bild: Watercryst
Zwischenfazit
Kalksteinbildung vollzieht sich nach physikalisch-chemischen Gesetzmäßigkeiten, die aufgrund der hohen Variabilität ihrer determinierenden Einflussgrößen (Temperatur, pH-Wert, Calcium- und Carbonationen) komplexer Modellrechnungen bedürfen. Eine mathematische Modellierung, um die Menge und Geschwindigkeit von Kalkablagerungen in Trinkwasser-Installationen vorherzusagen, ist allein aufgrund der wasserchemischen Gesetzmäßigkeiten und deren komplexer Zusammenhänge und Wechselwirkungen nur mit großem Aufwand und selten vollständig möglich.
Wenn man zusätzlich die Einflüsse der zeitlich und örtlich unterschiedlichen Betriebszustände einer Trinkwasser-Installation betrachtet, wie Stagnation und damit die verlängerte Kontaktzeit des Wassers mit den Rohrinnenwänden des Leitungssystems, Temperaturerhöhung oder turbulente Strömungen mit lokalen Kavitationserscheinungen, die zum Entweichen von Kohlensäure und damit zu einer Verschiebung des Kalk-Kohlensäure-Gleichgewichtes führen, werden exakte quantitative Vorhersagen für Kalkablagerungen unmöglich. Trotzdem sind das Kalk-Kohlensäure-Gleichgewicht und thermodynamische Modelle wichtige und hilfreiche Instrumente, um ein mögliches Risiko von Kalkablagerungen abzuschätzen. Sie tragen dazu bei, die technisch notwendigen prophylaktischen Schutzmaßnahmen zu identifizieren und umzusetzen.
Für das SHK-Handwerk, Planungs- und Ingenieurbüros bietet der Großhandel moderne und innovative Kalkschutzgeräte, die ohne den Einsatz chemischer Betriebsstoffe Kalkschutz auf hohem Niveau bieten und eine nachgewiesene Kalkschutzwirksamkeit nach dem DVGW-Arbeitsblatt W 510 haben. Seriöse Anbieter chemiefreier Kalkschutztechnik greifen dabei alle auf das Wirkprinzip zurück, Kristallkeime aus den im Wasser gelösten Calcium- und Carbonationen zu erzeugen, entweder auf elektrophysikalischer Basis oder auf Grundlage der heterogenen Katalyse.
Erprobte und zugelassene Kalkschutzverfahren
Die DIN 1988‑200 gibt unter Punkt 12.7 an, welche Anforderungen von Kalkschutzgeräten zur Verminderung von Steinbildung nachzuweisen sind: „Kalkschutzgeräte arbeiten nach dem Prinzip der Impfkristallbildung. Die Schutzwirkung wird mittels vom Gerät erzeugter, mikroskopisch kleiner Impfkristalle erzielt, an die sich Härtebildner beim Einstellen des Kalk-Kohlensäure-Gleichgewichts anlagern. Die Härtebildner verbleiben im Wasser. Eine Enthärtung findet bei Kalkschutzgeräten (…) nicht statt. Kalkschutzgeräte müssen DVGW W 510 entsprechen.“
Die Norm macht neben der technischen Beschreibung des Verfahrensweges einen entscheidenden Vorteil chemiefreier Kalkschutzanlagen deutlich: Die Mineralstoffzusammensetzung wird anders als bei Enthärtungsanlagen auf Grundlage des Ionentauschprinzips nicht verändert. Gesunde Mineralstoffe wie Calcium und Magnesium verbleiben im Wasser.
Damit erfüllen chemiefreie Kalkschutzgeräte einen wichtigen Aspekt im Kontext der EU-Trinkwasserrichtlinie 2020/2184, Ziffer 13. Dort heißt es: „Sicheres Wasser für den menschlichen Gebrauch bedeutet nicht nur die Abwesenheit schädlicher Mikroorganismen und Stoffe, sondern auch die Anwesenheit bestimmter Mengen an natürlichen Mineralien und lebensnotwendigen Elementen, wobei zu berücksichtigen ist, dass der langfristige Gebrauch von entmineralisiertem Wasser oder Wasser mit einem sehr geringen Gehalt an wesentlichen Elementen wie Kalzium und Magnesium die menschliche Gesundheit gefährden kann.“
Verfahrenstechnisch lässt sich der Prozess der Kalkkristallbildung in den jeweiligen Wasserbehandlungseinheiten der am Markt verfügbaren Kalkschutzgeräte wie folgt beschreiben: Über heterogene (z. B. Biocat von Watercryst) oder elektrophysikalische (z. B. Permasolvent Primus von Perma-Trade, AQA total Energy von BWT, i-balance und Biostat von Judo) Keimbildung entwickelte Kristallisationskerne aus CaCO3 gelangen in den zu behandelnden Wasserstrom, wachsen im kalkabscheidenden Wasser weiter und binden durch ihr Wachstum überschüssige Calcium- und Carbonationen an sich.
Das Wachstum dieser Kristallisationszentren erfolgt in Konkurrenz zu Wachstumsprozessen an der Wand; Verkalkungsprozesse an diesen werden dadurch effektiv gestoppt. Effizienz und Wirksamkeit dieses Prozesses können anhand des Prüfverfahrens gemäß DVGW W 510 und W 512 nachgewiesen werden.

Bild: Watercryst
Ausblick auf Teil 2
Der zweite Teil des Beitrags beschreibt detailliert den normierten Zertifizierungsprozess für das DVGW-Baumusterprüfzertifikat nach DVGW-Arbeitsblatt W 510 und W 512. Als Qualitätssiegel für die SHK-Branche ist die DVGW-Zertifizierung eine wichtige Orientierungshilfe für die nachgewiesene Kalkschutzwirksamkeit und Trinkwasserkonformität von Kalkschutzgeräten. Des Weiteren werden am konkreten Beispiel der Entwicklung zeitgemäßer Kalkschutztechnik die wasserchemischen Gesetzmäßigkeiten zur praxistauglichen Dimensionierung der Anlagenkapazität für unterschiedliche Anwendungsbereiche in Verbindung gesetzt. Teil 2 erscheint in der SBZ 05.24.
Kalkschutz mittels heterogener Katalyse
Die Kalkschutzwirksamkeit der Kalkschutzanlagen Biocat wird auf Grundlage des Wirkprinzips der Biomineralisierung erzielt. Die heterogen induzierte Kalkkristallbildung erfolgt mittels eines Katalysator-Granulates, das sich in der Wasserbehandlungseinheit befindet. Die Wasserhärte bleibt bei diesem Verfahren unverändert.
Alle 72 Stunden findet automatisiert eine thermische Desinfektion statt, d. h. das Kalkschutzgerät koppelt sich temporär von der Trinkwasser-Installation ab, damit sich das Wasser innerhalb der Kalkschutzanlage auf 80 °C erhitzen kann, um die hygienische Eigensicherheit der Kalkschutzanlage sicherzustellen. Dieser Prozessschritt ist ein wichtiger Baustein für die Trinkwasserhygiene-Prophylaxe.
Das Wirkprinzip

Bild: Watercryst

Bild: Watercryst

Bild: Watercryst
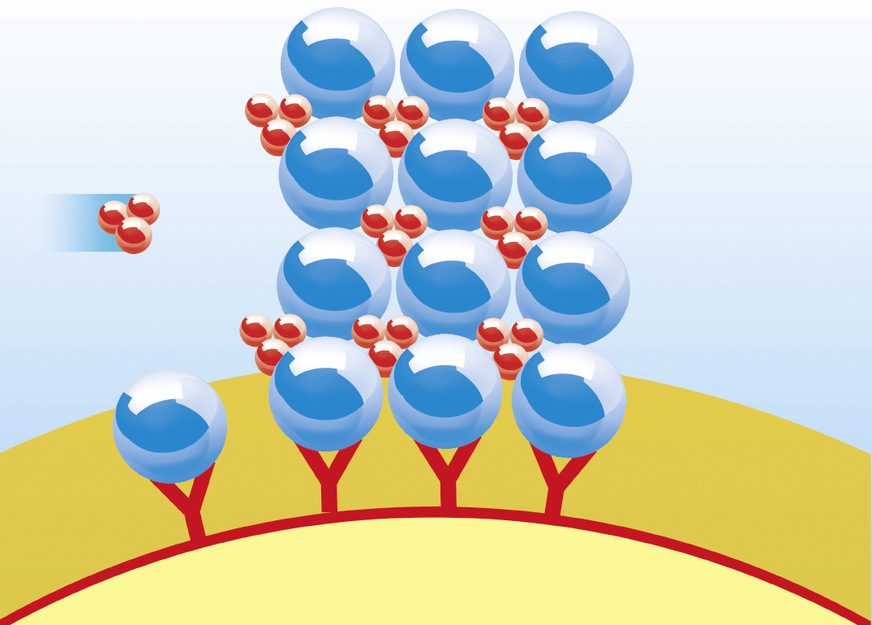
Bild: Watercryst
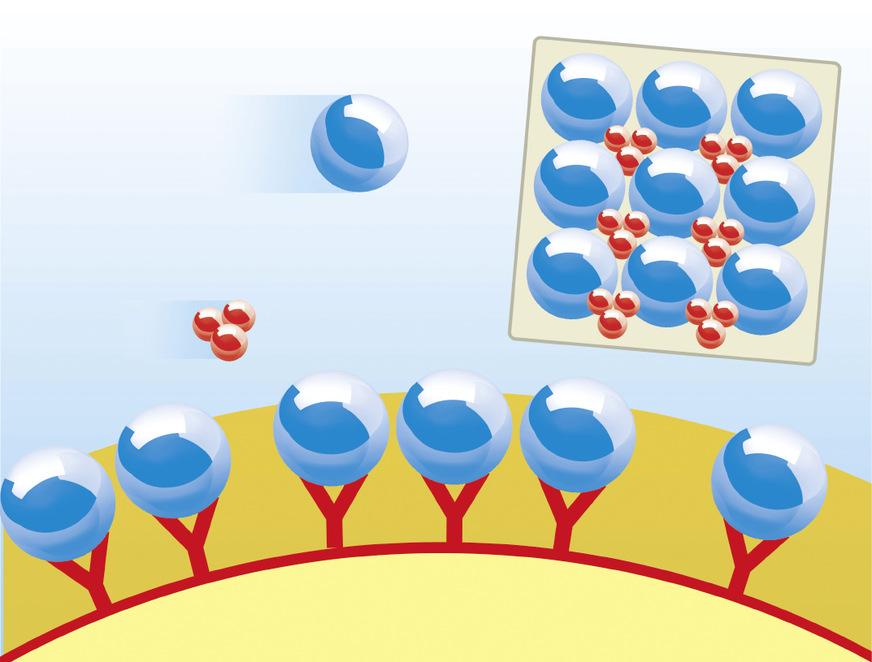
Bild: Watercryst
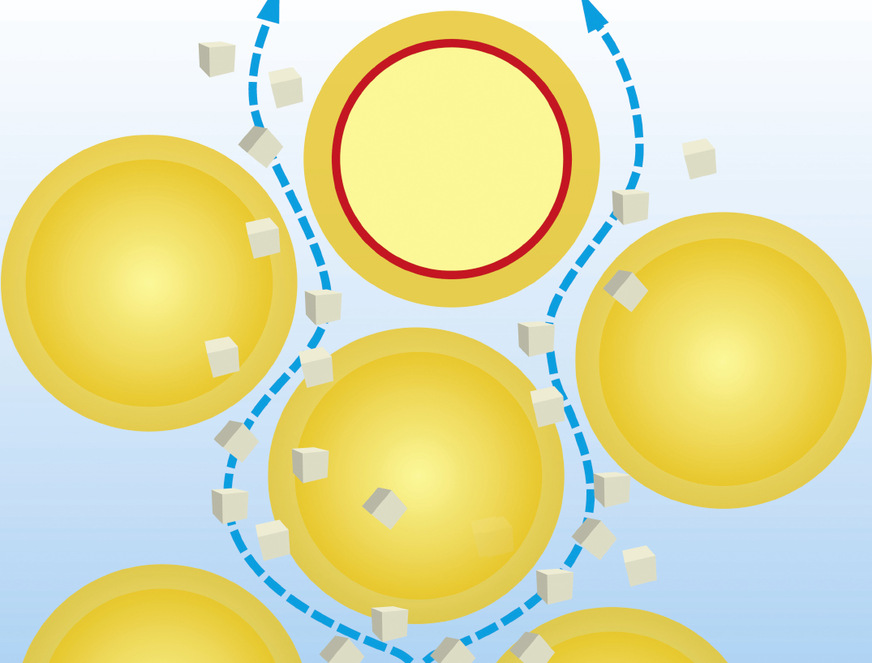
Bild: Watercryst
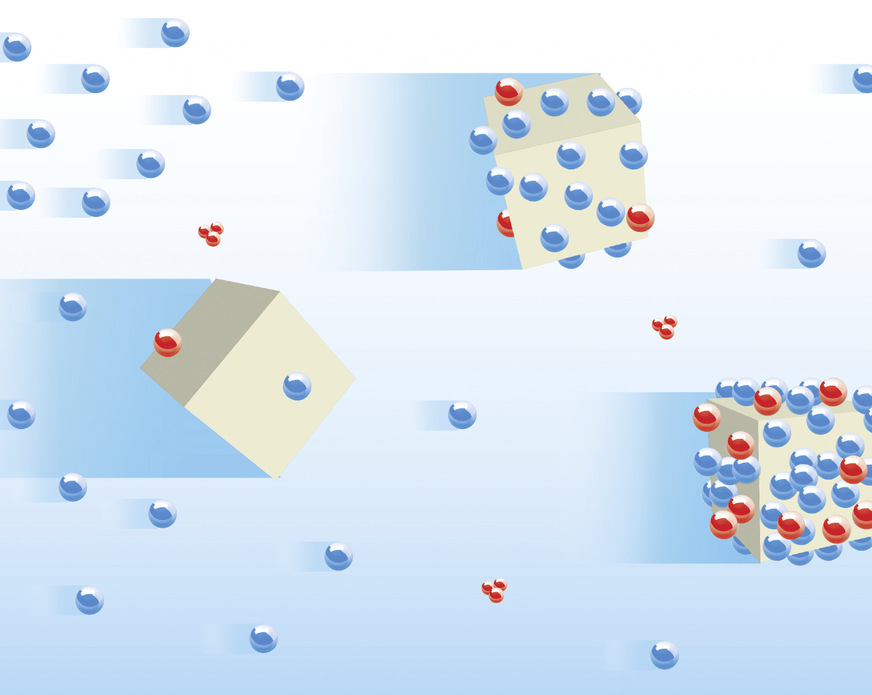
Bild: Watercryst









