Die Abwanderung der Bevölkerung aus strukturschwachen Regionen, der sinkende Pro-Kopf-Verbrauch und die Tendenz zum Singlehaushalt stellt die Wasserversorgung vor ernste Probleme: Der sinkende Wasserverbrauch führt zu längeren Verweilzeiten des Wassers in den Rohrleitungen. Hiervon sind nicht nur die öffentlichen Versorgungsleitungen betroffen, sondern auch die zudem tendenziell deutlich überdimensionierten Hauswasserleitungen von teilweise leer stehenden Mehrfamilienhäusern, unterbelegten Hotels, Bürogebäuden, Krankenhäusern und Altenheimen sowie wenig genutzten Sportstätten und Industrieanlagen.
Je nach Wasserqualität können längere Stagnationszeiten bei Rohren aus Eisenwerkstoffen zur Rostwasserbildung (Bild 1) und bei Kupferwerkstoffen zu erhöhter Kupferaufnahme des Wassers führen. Während Verbraucher wegen der unansehnlichen Farbe auf den „Genuss“ von Rostwasser automatisch verzichten, gibt es diesen Mechanismus bei erhöhtem Kupfergehalt nicht, da er weder zu sehen noch zu schmecken ist. In einer groß angelegten Studie des Umweltbundesamtes [1] sind nach nächtlicher Stagnation Kupfergehalte bis zu 6,95 mg/l in häuslichem Trinkwasser nachgewiesen worden. Der Grenzwert in der Trinkwasser-Verordnung 2001 beträgt für Kupfer 2 mg/l. Auch erhöhte Bleigehalte können dem Trinkwasser nicht angesehen werden. Bei der oben zitierten Studie des Umweltbundesamtes traten im Trinkwasser nach nächtlicher Stagnation Bleigehalte bis zu 2,19 mg/l auf. Der Grenzwert für Blei liegt gemäß Trinkwasser-Verordnung 2001 zurzeit bei 0,025 mg/l; ab Dezember 2013 gilt ein Grenzwert von nur noch 0,01 mg/l. Auf erhöhte Konzentrationen nach nächtlicher Stagnation kann ein Verbraucher zwar durch gründliches Spülen reagieren. Doch die oben aufgezeigte Tendenz macht klar, dass Grenzwertüberschreitungen, die heute nach nächtlicher Stagnation auftreten, in der Regel künftig auch am Tag zu erwarten sind.
Außer diesen gesundheitlichen und ästhetischen Aspekten können längere Stagnationszeiten in einer Hausinstallation auch zu technischen Problemen führen. So kann bei harten Wässern ein verstärkter Kalkausfall die Folge sein, der zu erhöhten Energie-, Reinigungs- und Reparaturkosten führt. Kalkausfall tritt vor allem bei der Erwärmung des Trinkwassers auf.
Zur Verminderung des Legionellenwachstums muss gemäß DVGW-Arbeitsblatt W 551 [10] am Austritt des Trinkwassererwärmers von Großanlagen eine Temperatur von mindestens 60 °C eingehalten werden. Auch bei Vorwärmstufen, bei denen der Speicherinhalt einschließlich Vorwärmstufe ≥400 l beträgt, muss der gesamte Speicherinhalt der Vorwärmstufe einmal am Tag auf mindestens 60 °C aufgeheizt werden. Für Kleinanlagen wird diese Temperatur ebenfalls empfohlen. Diese Temperaturen liegen über denen, die in der Vergangenheit aus Energieeinspargründen verwendet wurden. Höhere Temperaturen bedeuten aber eine höhere Gefahr der Verkalkung.
Lösungsansätze
Gegen die aufgezeigten Probleme kann zum Großteil mit einer gut abgestimmten Wasseraufbereitung vorgegangen werden. Vielfach hat sich die Dosierung von Mineralstoffen bewährt. Hierbei ist es wichtig, dass der Dosierwirkstoff auf das vorliegende Rohrmaterial und das Wasser abgestimmt wird.
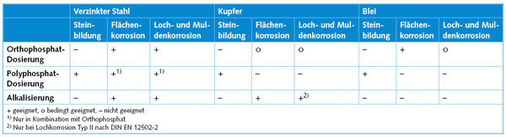
Eine Flächenkorrosion von verzinkten Rohrleitungen, die zu Rostwasserbildung führt, kann mit einer Orthophosphat-Dosierung gehemmt werden. Je nach Wasserhärte ist es notwendig, die Orthophosphate mit einem bestimmten Anteil Polyphosphat zu mischen, weil sonst das Orthophosphat gleich nach der Dosierung mit dem Calcium der Wasserhärte chemisch reagiert, Calciumphosphat bildet und bereits in der Nähe der Impfstelle ausfällt. Durch die Polyphosphat-Komponente wird die Ausfällung verzögert und der Wirkstoff bis in die Endstellen der Installation transportiert.
Die Polyphosphatkomponente übernimmt eine weitere wichtige Funktion. Sie schützt den Warmwasserbereich vor Kalkausfällungen. Schon geringe Kalkbeläge auf den Wärmeübertragungsflächen können zu einem verminderten Wärmeübergang und damit zu einem höheren Energieaufwand führen. Auch hier ist ein besonderes Augenmerk auf die Wirkstoffzusammensetzung zu legen: Polyphosphate können je nach Temperatur und pH-Wert des Wassers hydrolysieren, d.h. sie zersetzen sich zu Orthophosphaten, die keine härtestabilisierende Wirkung haben. Dies ist besonders zu beachten, wenn der Warmwasserbereich mit erhöhten Temperaturen zur Verminderung des Legionellenwachstums betrieben wird.
Bei Installationen aus Kupfer kann die Dosierung von Phosphat hinsichtlich der Kupferfreisetzung sowohl einen positiven wie auch einen negativen Effekt haben [2]. Dies hängt von der Rohwasserbeschaffenheit ab und bedarf einer detaillierten Überprüfung. Mittel der Wahl zur Minimierung einer Kupferabgabe sind deshalb alkalisierende Wirkstoffe. Hierfür sind sehr anspruchsvolle Wirkstoff-Zubereitungen notwendig, da einerseits bei einer Alkalisierung immer das Kalk-Kohlensäure-Gleichgewicht des Wassers verschoben wird und es somit zu einer Kalkausfällung im Bereich der Impfstelle kommen kann und außerdem die Zubereitung in sich stabil bleiben muss.
Einfluss der Wirkstoffe
Generell dürfen zur Trinkwasseraufbereitung nur Produkte eingesetzt werden, die in der Liste der Aufbereitungsstoffe und Desinfektionsverfahren gemäß § 11 Trinkwasserverordnung 2001 aufgeführt sind und den dort genannten Reinheitsanforderungen entsprechen. Gemäß dieser Liste beträgt die zulässige Zugabe von Ortho- bzw. Polyphosphaten 2,2 mg/l berechnet als P (Phosphor). Dieser Grenzwert kann in die früher üblichen Größen PO 4 3– (Phosphat) bzw. P 2 O 5 umgerechnet werden. Zwischen diesen Angaben liegt lediglich ein Umrechnungsfaktor. Es gilt: 2,2 mg/l berechnet als P entsprechen 6,7 mg/l berechnet als PO 4 3– und 5,0 mg/l berechnet als P 2 O 5
Phosphate
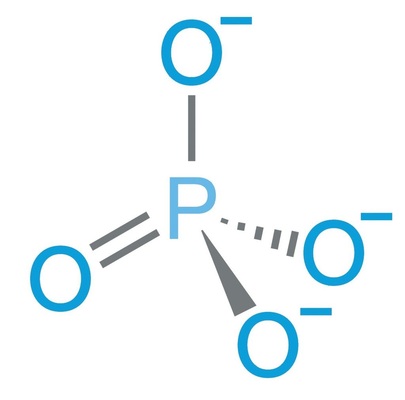
Als Rohstoffe dienen natürlich vorkommende Phosphaterze (Apatit), die bergmännisch abgebaut, chemisch umgewandelt, gereinigt und getrocknet werden. In der Wasseraufbereitung kommen zwei Arten von Phosphaten zum Einsatz: So genannte Orthophosphate und Polyphosphate. Orthophosphate sind Salze der Orthophosphorsäure mit der chemischen Formel PO 4 3– (Bild 2). Das Phosphat ist das Anion des Salzes und besteht aus den Elementen Phosphor und Sauerstoff. Das zughörige Kation des Salzes wird von einem Metall-Ion gebildet, zum Beispiel Natrium.
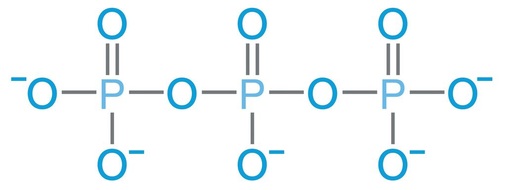
Polyphosphate sind Polymerisationsprodukte dieser Orthophosphate mit unterschiedlicher Kettenlänge. Bild 3 zeigt beispielhaft ein tri-Phosphat (eine Kette mit drei Phosphor-Atomen). Die Kette kann allerdings analog weiter fortgesetzt werden und somit noch sehr viel länger werden, also aus sehr viel mehr Phosphor-Atomen bestehen.
Orthophosphate
Orthophosphate besitzen eine ausgezeichnete Korrosionsschutzwirkung gegenüber Eisenwerkstoffen wie Guss, Stahl und verzinktem Stahl [3, 4]. Unter dem Einfluss des Phosphats entstehen stabile, deckschichtverbessernde Korrosionsprodukte des Eisens und des Zinks (Eisen-Zink-Phosphate). Durch die Verbesserung der Deckschichtbildung ist so eine deutliche Verringerung der ins Wasser übertretenden Korrosionsprodukte möglich. Sogar auf bestehenden Rostschichten und Rostknollen kann so mit der Zeit eine stabile Eisenphosphat-Schutzschicht aufwachsen und einer Rostwasserbildung entgegenwirken.
Auch bei Kupferwerkstoffen kann die gleichmäßige Flächenkorrosion durch die Zugabe von Orthophosphaten vermindert werden [5]. In diesem Fall sind die Zusammenhänge jedoch nicht so eindeutig wie bei den Eisenwerkstoffen. Nach [2] beeinflusst der Gehalt und die Zusammensetzung des im Wasser vorhandenen TOC (total organic carbon; gesamter organischer Kohlenstoff) die Wirkungsweise des Phosphats. Organische Wasserinhaltsstoffe (Huminstoffe) können die Deckschichtbildung auf der Rohrinnenoberfläche negativ beeinflussen, indem die Kristallisationskinetik von Malachit verlangsamt wird. Hohe Kupferkonzentrationen im Wasser sind die Folge. Liegen diese Umstände vor, kann die Kupferkonzentration im Stagnationswasser durch eine Orthophosphat-Dosierung verringert werden.
Auch bei Bleileitungen kann die Bleifreisetzung durch die Dosierung von Orthophosphat vermindert werden [6]. Allerdings kann nicht vorhergesagt werden, ob durch diese Maßnahme der Bleigehalt soweit verringert wird, dass der Grenzwert gemäß Trinkwasserverordnung eingehalten werden kann. Zumindest kann die Phosphat-Dosierung aber bis zum Austausch der Altinstallation als Überbrückungsmaßnahme dienen.
Polyphosphate
Polyphosphate haben eine ausgeprägte härtestabilisierende Wirkung. Gemäß [7] können sie bis zu einer Gesamthärte von 3,8 mol/m 3 (21 °dH) zum Schutz vor Steinbildung eingesetzt werden. Polyphosphate wirken als sogenannte Threshold-Inhibitoren, d.h. sie verhindern in unterstöchiometrischen Mengen die Ausfällung von Härtebildnern. Zwischen dem Threshold-Inhibitor und den Härtebildnern entsteht keine chemische Bindung, es wird aber die Kinetik der Reaktion beeinflusst: Die Ausfällung von Kalk (Calcit) wird durch Polyphosphat zeitlich verzögert, je nach Umgebungsbedingungen (pH-Wert, Temperatur usw.) möglicherweise unendlich lange. Nach Raistrick [8, 9] kann der Threshold-Effekt folgendermaßen erklärt werden:
Die Ca 2+ -Ionen liegen im Calcit-Kristall senkrecht zur dreizähligen Symmetrieachse an den Ecken gleichseitiger Dreiecke, wobei die Ca-Ca-Abstände 4,96 Angström (0,496 nm) betragen. Das kettenförmige Molekül des Polyphosphats kann sich an den Gitterebenen des Calcits anlagern, da im Polyphosphat-Molekül der Abstand der Sauerstoff-Atome zueinander 4,99 Angström beträgt und somit in etwa dem Ca-Ca-Abstand des Calcit-Kristalls entspricht (Bild 4).
Hydrolyse der Polyphosphate
Durch Reaktion mit Wasser können Polyphosphate zu Orthophosphaten zersetzt werden. Diese Reaktion wird als Hydrolyse bezeichnet. Die Reaktionsgeschwindigkeit ist vor allem abhängig von der Art des Polyphosphats (Kettenlänge), der Temperatur und dem pH-Wert des Wassers. Hohe Temperaturen und ein tiefer pH-Wert erhöhen die Reaktionsgeschwindigkeit. Bei neutralem pH-Wert und bei Zimmertemperatur können Polyphosphate dagegen über Monate bis Jahre stabil bleiben. Es ist daher sehr wichtig, dass unter der Vielzahl der zur Verfügung stehenden Polyphosphate das richtige für den jeweiligen Anwendungsfall ausgewählt wird.
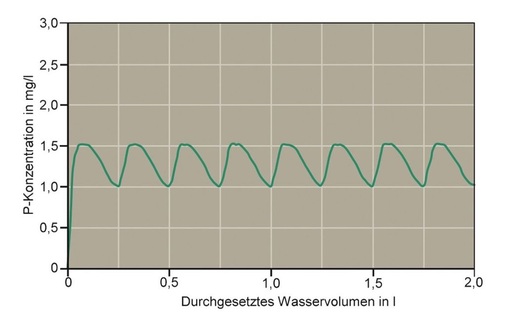
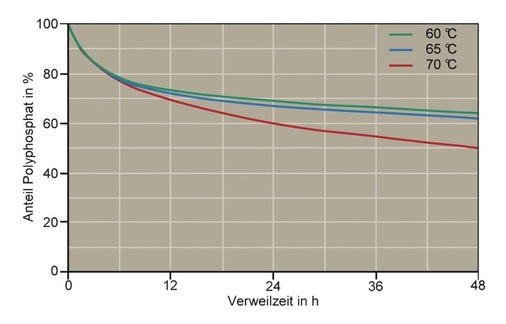
Aus Bild 5 ist zum Beispiel zu erkennen, dass der Polyphosphat-Anteil des Produkts Quantophos F4 nach 8 h Verweilzeit bei einer Temperatur von 70 °C und einem pH-Wert von 6,5 erst zu ca. 25 % hydrolysiert ist. Selbst nach 48 h sind noch 50 % Polyphosphat vorhanden und dies bei einem pH-Wert von 6,5, dem nach Trinkwasserverordnung niedrigsten zulässigen pH-Wert. Laborversuche mit Quantophos F4 haben gezeigt, dass dieser Anteil bei einer Ausgangskonzentration von 1,3 mg/l Phosphat (berechnet als P) ausreicht, um über 48 h 98 bis 100 % der Wasserhärte am Ausfall zu hindern (Bild 6). 1,3 mg/l P entsprechen lediglich 60% der nach TrinkwV 2001 zulässigen Zugabe.
Eine teilweise Hydrolyse der Polyphosphate ist manchmal sogar wünschenswert, da die sich bildenden Orthophosphate wie oben beschrieben als Korrosionsinhibitoren wirken können. Bei der Trinkwassererwärmung liegen die hydrodynamischen Verweilzeiten in Speicher-Wassererwärmern bei Einfamilienwohnhäusern im Bereich von 19 bis 24 h und bei Mehrfamilienwohnhäusern im Bereich 2 bis 7 h.
Phosphor ist lebensnotwendig
Die ernährungsphysiologische Komponente der im Lebensmittelbereich zugelassenen Phosphate ist der Phosphor. Phosphor ist in der Form von Calciumphosphat die strukturgebende Komponente der Knochen. Außerdem ist Phosphor ein wichtiger Bestandteil der Zellmembranen. Phosphor spielt eine lebenswichtige Rolle im Energiestoffwechsel des Körpers, es ist entscheidend bei der Energieproduktion und -speicherung beteiligt [9]. Bei Kindern wirkt sich ein Phosphormangel durch verzögertes Wachstum, schlechte Knochen- und Zahnbildung und Rachitis aus. Phosphormangel kann in jedem Alter zu Gewichtsverlust, Knochenabbau und Müdigkeit führen. Ein Mangel an Phosphor kann lange Zeit verborgen bleiben, da Phosphor aus den Knochen mobilisiert, also abgebaut wird. Nach längerer verminderter Zufuhr von Phosphor tritt die so genannte Hunger-Knochenerweichung auf. Tierversuche haben gezeigt, dass Phosphormangel im Extremfall zum Tod durch Kräfteverfall führen kann.
Die Deutsche Gesellschaft für Ernährung geht bei Erwachsenen von einem Tagesbedarf von etwa 700 mg Phosphor aus. Schwangere und stillende Frauen sollten etwas mehr zu sich nehmen. Für diesen Personenkreis werden 800 bis 900 mg Phosphor als Referenzwert genannt. Jugendliche im Wachstum benötigen ebenfalls etwas mehr Phosphor.
Phosphat in Lebensmittel
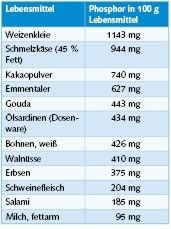
Phosphate werden vielen Lebensmitteln als Stabilisatoren und Verdickungsmittel zugesetzt. In Bild 7 sind übliche Phosphorgehalte verbreiteter Lebensmittel aufgeführt. Trinkwasser darf nach TrinkwV maximal 2,2 mg/l Phosphat berechnet als Phosphor zugesetzt werden. Diese Menge ist im Vergleich zu den Phosphormengen, die in Lebensmitteln enthalten sind, äußerst gering.
Zur Veranschaulichung: Isst ein Mensch 60 g Schmelzkäse und trinkt dazu 0,25 l Milch, so hat er mit dem Schmelzkäse 566 mg und mit der Milch 261 mg Phosphor aufgenommen. Um diese 827 mg Phosphor durch Trinkwasser aufzunehmen, müsste er 376 l behandeltes Wasser trinken.
Dosiertechnik
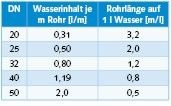
Bei einer Wasserentnahme misst ein Kontaktwasserzähler die durchfließende Wassermenge. Der Kontaktwasserzähler gibt in einem bestimmten Abstand (üblich sind 2 l) einen Impuls an eine elektronisch gesteuerte Dosierpumpe. Dieser Impuls löst einen Dosierhub aus, wodurch eine definierte Menge des Wirkstoffes in die Wasserleitung dosiert wird. Bei der Wahl der Dosiertechnik sollte der Planer allerdings beachten, dass eine sehr lange Rohrstrecke benötigt wird, um diese 2 l zu fassen (Bild 8). Es ist gut zu erkennen, dass selbst bei einer Rohrleitung DN 25 bei einem Impulsabstand von 2 l nur auf 4 m Rohrleitung ein Dosierhub erfolgt. Oder anders ausgedrückt, im Abstand von 4 m schiebt sich ein Pfropfen Dosiermittel durch das Leitungssystem. Eine optimierte Dosiertechnik ist deswegen besonders wichtig.
Bei der Medo-Dosiertechnik von BWT kommt ein Schrittmotorsystem zum Einsatz (Bild 9). Jeder Dosierhub wird dabei auf 48 Einzelschritte aufgeteilt. Hierdurch wird bereits bei der Dosierung eine gleichmäßige Einmischung des Wirkstoffs erreicht. So wird sichergestellt, dass die Dosiermittel ihre Wirkung hinsichtlich Schutzschichtbildung und Kalkstabilisierung optimal entfalten können. Durch die Schrittmotortechnik kann die Dosierpumpe mit Kontaktwasserzählern mit sehr kleinem Impulsabstand kombiniert werden. So können zum Beispiel die BWT Quantophos Wirkstoffe zusammen mit einer BWT Medo-II-Dosierpumpe bis zu einem Wasser-Volumenstrom von 30 m 3 /h mit einem Kontaktwasserzähler von 0,25 l Impulsabstand kombiniert werden.
Eine Mineralstoffdosierung zur Vermeidung von Korrosionsschäden und Steinbildung in trinkwasserführenden Anlagen von Wohn- und Nutzgebäuden ist insbesondere dann das Verfahren der Wahl, wenn eine ungünstige Kombination aus Rohrleitungswerkstoff, pH-Wert und Zusammensetzung des Wassers vorliegt und die aktuellen Grenzwerte der Trinkwasserverordnung für Schwermetalle ansonsten nicht einzuhalten wären. Die Auswahl des richtigen Dosiermittels und auch die Dosiertechnik selbst sind von entscheidender Bedeutung für den Verfahrenserfolg (Bild 10). Wichtig ist, dass die Dosierung automatisiert ist und das Dosiermittel kontinuierlich zugegeben wird. Die richtige Einstellung der Dosierung lässt sich jederzeit durch eine Wasseranalyse feststellen.
Literatur
[1] Umweltbundesamt, Kinder-Umwelt-Survey 2003/2006, Trinkwasser – Elementgehalte im häuslichen Trinkwasser aus Haushalten mit Kindern in Deutschland; C. Schultz et al.
[2] Jürgen Dartmann, Thorsten Dorsch, Klaus Johannsen: Einfluss einer pH-Änderung und der Phosphatdosierung auf die Kupferkorrosion in Trinkwasserleitungen, 2006
[3] DIN EN 12502 Korrosionsschutz metallischer Werkstoffe – Hinweise zur Abschätzung der Korrosionswahrscheinlichkeit in Wasserverteilungs- und -speichersystemen – Teil 3: Einflussfaktoren für schmelztauchverzinkte Eisenwerkstoffe. Berlin: Beuth Verlag, März 2005
[4] Dr. rer. nat. Johann Wilhelm Erning, Bundesanstalt für Materialforschung und -prüfung: Korrosionsschutz durch Zusatzstoffe. Berlin: 19. Mülheimer Wassertechnisches Seminar 1. März 2005
[5] DIN EN 12502 Korrosionsschutz metallischer Werkstoffe – Hinweise zur Abschätzung der Korrosionswahrscheinlichkeit in Wasserverteilungs- und -speichersystemen – Teil 2: Einflussfaktoren für Kupfer und Kupferlegierungen. Berlin: Beuth Verlag, März 2005
[6] DIN 50930 Korrosion metallischer Werkstoffe im Inneren von Rohrleitungen, Behältern und Apparaten bei Korrosionsbelastung durch Wässer, Teil 6 Beeinflussung der Trinkwasserbeschaffenheit. Berlin: Beuth Verlag, August 2001
[7] VDI 6001, Sanierung von sanitärtechnischen Anlagen – Trinkwasser, Blatt 1. Berlin: Beuth Verlag Juli 2004
[8] M.N. Elliot, Scale Control by Theshold Treatment, Desalination; 8, 221-236, 1970
[9] World Health Organization: Nutrients in drinking water, 2005
[10] DVGW Arbeitsblatt W 551, Trinkwassererwärmungs- und Trinkwasserleitungsanlagen; Technische Maßnahmen zur Verminderung des Legionellenwachstums; Planung, Errichtung, Betrieb und Sanierung von Trinkwasser-Installationen. Bonn: wvgw Wirtschafts- und Verlagsgesellschaft Gas und Wasser mbH, April 2004
Weitere Informationen
Unser Autor Dipl.-Ing. Thomas Schmidt ist Leiter Anwendungstechnik und Labor bei BWT Wassertechnik, 69198 Schriesheim, Telefon (0 62 03) 7 32 29, E-Mail: thomas.schmidt@bwt.de



![Bild 4 Schematische Darstellung des Threshold-Effektes der Polyphosphate nach [8]. Im Calcit-Kristall betragen die Ca-Ca-Abstände 4,96 Angström. Das kettenförmige Molekül des Polyphosphats kann sich an den Gitterebenen des Calcits anlagern, da im Polyphosphat-Molekül der Abstand der Sauerstoff-Atome zueinander 4,99 Angström beträgt Bild 4 Schematische Darstellung des Threshold-Effektes der Polyphosphate nach [8]. Im Calcit-Kristall betragen die Ca-Ca-Abstände 4,96 Angström. Das kettenförmige Molekül des Polyphosphats kann sich an den Gitterebenen des Calcits anlagern, da im Polyphosphat-Molekül der Abstand der Sauerstoff-Atome zueinander 4,99 Angström beträgt](/sites/default/files/styles/image_gallery__s/public/ulmer/de-sbz/image/binarydata_big_252259.jpg?itok=cCb8CGwl)